Malati di diabete liberi dall’insulina? Il primo trapianto e la discussione tra scienziati sull’uso di cellule ‘camuffate’

Da decenni la ricerca sul diabete di tipo 1 insegue uno degli obiettivi più ambiziosi: liberare i pazienti dalla dipendenza quotidiana dall’insulina. Un traguardo che oggi sembra meno lontano grazie al caso di un uomo di 42 anni, il primo al mondo ad aver ricevuto un trapianto di cellule pancreatiche geneticamente modificate per resistere agli attacchi del sistema immunitario. La novità è che, a differenza dei trapianti tradizionali, questo intervento non richiede farmaci immunosoppressori. Un passo che assume rilievo in un contesto in cui, secondo l’International Diabetes Federation, oltre 537 milioni di adulti nel mondo convivono con il diabete, una cifra destinata a crescere nei prossimi decenni.
In Italia, i dati dell’Istituto Superiore di Sanità indicano che la malattia interessa circa 4 milioni di persone, pari al 6-7% della popolazione adulta; tra questi, circa 300.000 hanno il diabete di tipo 1, la forma autoimmune più severa, che richiede insulina per tutta la vita.
Il paziente zero e la sfida delle cellule immunoresistenti
Lo studio, pubblicato sul New England Journal of Medicine e condotto da un gruppo dell’Università di Uppsala guidato dal biologo cellulare Per-Ola Carlsson, segna un passaggio inedito nella lunga storia dei trapianti cellulari per il diabete di tipo 1. In passato si erano già tentati trapianti di isole pancreatiche da donatori, ma la necessità di assumere per tutta la vita farmaci immunosoppressori, con effetti collaterali anche gravi (dall’aumento del rischio di infezioni ai danni renali), ne aveva sempre limitato l’utilizzo clinico. Questa volta, invece, la sfida è stata diversa: rendere le cellule trapiantate invisibili al sistema immunitario.
Ti potrebbe interessare
- 10 falsi miti sull’influenza: dai vaccini e la vitamina C fino al colpo d’aria
- Alessia Lautone e gli effetti collaterali del farmaco dimagrante: «Prima la stanchezza, poi i pensieri suicidi. Ero come sdoppiata»
- Arrestata l’«Ostetrica senza Filtri» che promuoveva il parto in casa: è accusata dell’omicidio di un neonato in Australia
Per farlo i ricercatori hanno utilizzato la tecnica CRISPR-Cas9: hanno preso cellule pancreatiche da un donatore deceduto e le hanno “ripulite” geneticamente, inattivando due geni che regolano la produzione di antigeni HLA, le proteine che di norma segnalano al sistema immunitario se una cellula è propria o estranea. Parallelamente hanno potenziato un gene che esprime una proteina capace di inibire l’attacco delle cellule natural killer e dei macrofagi, i due principali “soldati” immunitari coinvolti nei rigetti.

Il risultato è stato un lotto di circa 80 milioni di cellule, che sono state iniettate nel muscolo dell’avambraccio del paziente. Non si tratta di una scelta casuale: a differenza del fegato, sede tradizionale dei trapianti di isole pancreatiche, il muscolo offre un ambiente più accessibile e meno rischioso per monitorare nel tempo l’attecchimento delle cellule. Dopo 12 settimane, i ricercatori hanno osservato che le cellule erano ancora vive e attive nella produzione di insulina, senza alcun segno di rigetto. «È il momento più entusiasmante della mia carriera scientifica», ha commentato Carlsson, sottolineando che questo approccio «potrebbe aprire la strada non solo a nuove terapie per il diabete, ma anche a trattamenti per altre malattie autoimmuni».
Un segnale incoraggiante: il corpo torna a fare insulina da solo
Dopo l’intervento, i ricercatori hanno seguito il paziente per diversi mesi, monitorando i livelli di insulina e i principali parametri metabolici. Prima del trapianto, come accade nella maggior parte dei casi di diabete di tipo 1 di lunga durata, il paziente non produceva insulina misurabile. Quattro settimane dopo l’infusione delle cellule modificate, è comparsa per la prima volta una quota rilevabile di produzione autonoma dell’ormone. Nelle settimane successive la secrezione si è mantenuta stabile, fino a coprire circa il 7% del fabbisogno totale. Si tratta di una quantità ancora insufficiente per sospendere le iniezioni quotidiane, ma che rappresenta una dimostrazione senza precedenti: cellule pancreatiche trapiantate possono sopravvivere, attecchire e funzionare senza bisogno di farmaci immunosoppressori.
Per confermare l’efficacia del trapianto, i ricercatori hanno misurato anche il C-peptide, una sostanza che viene rilasciata insieme all’insulina e che quindi permette di capire se il corpo del paziente stia davvero ricominciando a produrla da solo. Hanno controllato inoltre l’emoglobina glicata, un parametro che indica quanto bene viene gestita la glicemia nel tempo. Tutti i dati hanno confermato che le cellule erano non solo vive, ma anche attive nel contribuire al controllo degli zuccheri nel sangue. «Il fatto che queste cellule siano rimaste vitali e abbiano iniziato a produrre insulina senza immunosoppressione è di per sé un risultato straordinario», ha sottolineato Carlsson, ricordando però che «siamo ancora all’inizio: serviranno più pazienti e follow-up più lunghi per capire il reale potenziale di questa terapia».
Una sfida mondiale
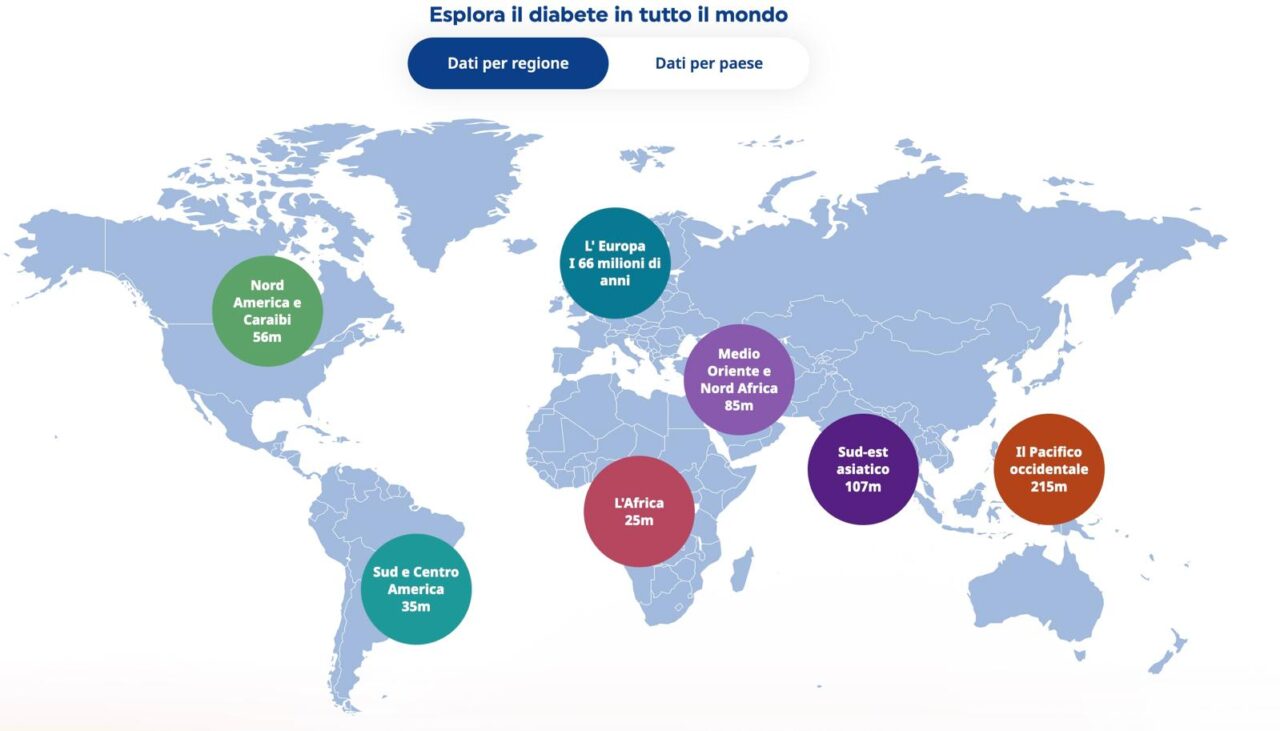
Dietro il successo sperimentale del singolo paziente si staglia una realtà ben più ampia: il diabete è una delle malattie croniche che l’Organizzazione Mondiale della Sanità considera tra le principali cause di morte e disabilità a livello globale. Non si tratta soltanto di una patologia metabolica, ma di una condizione che moltiplica il rischio di malattie cardiovascolari, ictus, insufficienza renale cronica, retinopatia fino alla cecità e amputazioni degli arti inferiori. Secondo i dati OMS, il diabete è responsabile ogni anno di circa 1,5 milioni di decessi diretti, cifra che sale a oltre 6 milioni se si considerano anche le morti legate alle sue complicanze.
L’impatto si estende anche sul piano socio-economico. Uno studio pubblicato su The Lancet Diabetes & Endocrinology ha stimato che nel 2015 il diabete sia costato al mondo 1,31 trilioni di dollari, pari all’1,8% del PIL globale, tra spese sanitarie e perdita di produttività. Nei paesi a basso e medio reddito, dove l’accesso all’insulina e alle cure è ancora limitato, questo peso si traduce in disuguaglianze drammatiche: secondo l’OMS, in alcune aree dell’Africa solo un paziente su due ha accesso regolare all’insulina necessaria per sopravvivere.
Per chi convive con il diabete di tipo 1, l’insulina resta un farmaco salvavita, ma non sempre facile da gestire: richiede dosaggi precisi, controlli glicemici costanti e comporta un rischio continuo di ipoglicemie severe. È in questo contesto che ogni ricerca capace di ridurre la dipendenza dall’insulina iniettata assume un significato che va oltre il laboratorio: rappresenta la possibilità di migliorare non solo la salute dei singoli, ma anche la sostenibilità dei sistemi sanitari e l’equità nell’accesso alle cure.
Dal diabete alla sclerosi multipla: le potenzialità della medicina rigenerativa
L’innovazione testata sul diabete di tipo 1 apre uno scenario che va oltre questa singola malattia. Alla base c’è un concetto semplice ma rivoluzionario: se si riescono a rendere invisibili al sistema immunitario le cellule trapiantate, diventa possibile pensare a terapie cellulari anche per altre patologie autoimmuni, in cui il corpo attacca i propri tessuti. Oggi condizioni come l’artrite reumatoide, la sclerosi multipla o il morbo di Crohn vengono trattate soprattutto con farmaci immunosoppressori, che riducono l’attività delle difese ma al prezzo di aumentare la vulnerabilità a infezioni e altre complicanze. Immaginare invece di sostituire i tessuti danneggiati con cellule “camuffate” che possano svolgere la loro funzione indisturbate significa aprire un nuovo capitolo della medicina rigenerativa.
Per esempio, nella sclerosi multipla il bersaglio è la guaina mielinica che riveste i neuroni; nel Crohn l’infiammazione colpisce in profondità la mucosa intestinale; nell’artrite reumatoide è la membrana sinoviale delle articolazioni a essere aggredita. In tutti questi casi, l’idea di poter reinserire cellule sane e protette dal sistema immunitario potrebbe significare riparare direttamente i danni invece di limitarne solo le conseguenze. È uno scenario ancora lontano, ma che entusiasma molti ricercatori. Come ha osservato Per-Ola Carlsson commentando i risultati ottenuti: «Questa tecnica non riguarda solo il diabete. Potrebbe cambiare il modo in cui affrontiamo molte malattie autoimmuni, per le quali oggi non abbiamo una cura definitiva».
Foto in evidenza di Nataliya Vaitkevich