Coronavirus, gli Stati Uniti hanno autorizzato il primo test rapido «fai da te» per uso emergenziale
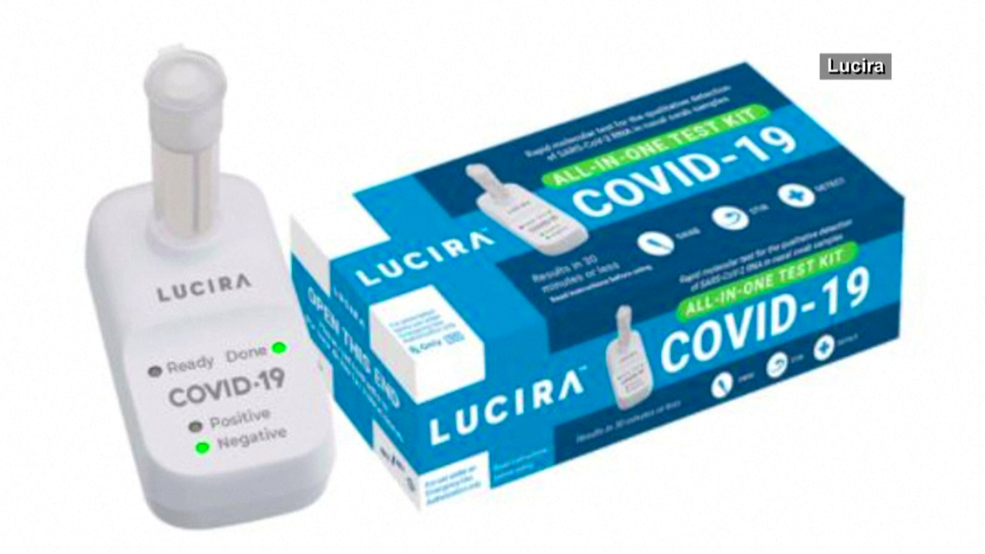

Dopo il via libera al test rapido antigenico fai da te della Abbott, la FDA (Food and Drug Administration), massima autorità americana per il controllo dei farmaci, concede l’autorizzazione per «uso emergenziale» anche a quello della società biotecnologica Lucira Health. Allora perché viene considerato il primo? Se per quello della Abbott al momento è concesso l’uso da parte di tecnici, su operatori sanitari, previa prescrizione medica; il kit della Lucira Health sarebbe il primo a poter essere condotto interamente in casa, per trovare tracce genomiche del nuovo Coronavirus.
Differenze tra il kit antigenico di Abbott e quello molecolare di Lucira Health
Il dispositivo, denominato Lucira COVID-19 All-In-One Test Kit, diversamente da quello antigenico della Abbott, è di tipo molecolare (trova le tracce del RNA virale). Non si limita quindi a trovare l’antigene di SARS-CoV-2, bensì, è costituito da «una tecnologia di amplificazione molecolare per il rilevamento dell’RNA SARS-CoV-2 in pazienti con COVID-19 noto o sospetto». Il tampone nasale immediatamente testato dal dispositivo, ridurrebbe notevolmente i tempi richiesti per un test RT-PCR standard.
Se la sfida dei test rapidi antigenici, partita proprio dagli Stati Uniti, consisteva nell’avere riscontri veloci che rilevassero almeno la presenza accertata di negativi, con dei kit diagnostici fai da te paragonabili a quelli di gravidanza; inversamente dei test rapidi molecolari, potrebbero accertare in tempi ridotti – e in mancanza di accedere ad alternative più affidabili, come l’analisi in laboratorio tramite PCR – la presenza di positivi.
Per approfondire:
Gli antigeni riconosciuti nelle analisi antigeniche, sono proteine che si trovano attorno al virus e che gli permettono di attaccare le cellule bersaglio, dove potrà moltiplicarsi, sono anche il principale bersaglio delle cellule del nostro sistema immunitario, che può cosi riconoscere il patogeno. Sulla base di questo meccanismo sono studiati anche appositi vaccini, che hanno il compito di simulare la presenza del virus, rafforzando il nostro organismo, senza farlo incorrere ai danni di una infezione vera. L’RNA, che delle analisi molecolari sono chiamate a individuare, è l’acido nucleico trasportato dal SARS-CoV-2, contenente le informazioni per moltiplicarsi nelle nostre cellule.
- Suggeriamo la lettura della nostra Guida a tutti i tipi di test diagnostici;
- Nella nostra Guida ai vaccini anti-Covid trovate approfondimenti su RNA e antigeni;
- Si tiene conto di analisi molecolare e antigeni anche nella nostra Guida alle terapie anti-Covid.
Limiti e opportunità dei test rapidi molecolari
Oggi per una analisi molecolare PCR, tra tempi di trasporto e analisi occorrono fino a 72 ore per ottenere un esito. Il test rapido molecolare richiederebbe solo mezz’ora, con un prezzo complessivo di 50 dollari. Tenuto conto che si tratta di un dispositivo monouso, e della necessità per i test molecolari standard di essere ripetuti, non sembra al momento una soluzione a buon mercato. Inoltre, è sempre possibile ottenere dei falsi negativi, ragione per cui un singolo kit potrebbe non bastare a priori. Ma come per tutti i prototipi, non è da escludere che in futuro si riesca a ridurre i costi, migliorandone l’affidabilità.
Cos’è una EUA (autorizzazione per uso emergenziale)
Quando la FDA concede una EUA (emergency use autorization) per questo genere di dispositivi, lo fa comunque previa prescrizione medica, in presenza di sintomi sospetti. Il punto in questo frangente è avere maggiori supporti nel tracciamento dei positivi.
«Gli operatori sanitari prescrittori sono tenuti a riferire tutti i risultati dei test che ricevono dalle persone che usano il test alle autorità sanitarie pubbliche competenti in conformità con i requisiti locali, statali e federali – continua l’FDA nel suo comunicato – Lucira Health, il produttore del test, ha anche sviluppato l’etichettatura delle scatole, istruzioni di riferimento rapido e istruzioni per gli operatori sanitari per assistere con la segnalazione».
Foto di copertina: Lucira Health | Lucira COVID-19 All-In-One Test Kit.
Leggi anche:
- Coronavirus, la nuova ondata torna a far paura a New York: richiudono le scuole. In Brasile salgono di nuovo le vittime dopo il voto per le Comunali
- Coronavirus, a che punto sono i tamponi fai da te in Italia e perché c’è ancora da aspettare
- Zaia: «Se i tamponi fai-da-te vengono approvati, magari a Natale facciamo prima il test e poi il cenone» – Il video
- Coronavirus, ecco perché l’indice RT da solo non è sufficiente per abbassare la guardia in vista del Natale
- Coronavirus, Moderna versus Pfizer: i due vaccini (che fanno sperare il mondo) a confronto
- Coronavirus. Il nuovo Dpcm sarà efficace? Cosa dicono i dati: le differenze tra prima e seconda ondata
- «Fare di più e fare meglio»: l’appello di un gruppo di scienziati in prima linea per fermare il Coronavirus
- Coronavirus. Abbiamo un problema: potrebbe diventare endemico e per evitarlo non bastano solo i vaccini
- Coronavirus, trovati anticorpi specifici in pazienti mai stati infettati
- Coronavirus, come funziona il vaccino a mRNA di Pfizer e perché sembra essere promettente
