Covid-19, arrivano in Italia le prime 150 mila dosi di monoclonali: ecco chi può essere curato, dove e come. E qual è la loro efficacia


In tempo di pandemia la ricerca di un farmaco risolutivo, utile per uscire dall’emergenza sanitaria, ha portato alla ribalta mediatica i tanto discussi anticorpi monoclonali contro la Covid19. Dopo il via libera dell’Aifa, con decreto del 6 febbraio che ne autorizza la distribuzione in situazione di emergenza, le prime 150 mila dosi acquistate dal Governo per un valore intorno ai 100 milioni di euro, una parte dei 700 milioni previsti dal decreto Sostegni per l’acquisto di farmaci anti Covid19, verranno distribuite in alcuni centri ospedalieri del Lazio, della Toscana e della Campania. Mentre in Liguria per alcuni pazienti la cura è già iniziata. I monoclonali in questione sono l’anticorpo di Eli Lilly (bamlanivimab) e il cocktail di Regeneron (imdevimab e casirivimab, già usati per trattare l’autunno scorso Donald Trump).
Secondo quanto previsto dal decreto del 9 marzo 2021, gli operatori sanitari potranno somministrare gli anticorpi monoclonali in via preventiva a pazienti con sintomi lievi allo scopo di prevenire l’aggravarsi della malattia e ridurre il carico delle ospedalizzazioni, il tutto a determinate condizioni che devono essere rispettate dai centri ospedalieri individuati dalle Regioni. Ma benché sia una buona notizia, ci vorrà ancora del tempo prima di vedere uno studio che confermi le rosee aspettative sui farmaci.
Per chi ha fretta
- I monoclonali sono farmaci basati su anticorpi ricavati dal plasma di pazienti convalescenti;
- Le principali aziende coinvolte hanno ottenuto permessi emergenziali da parte degli enti regolatori, mostrando un’efficacia del 70%;
- Possono essere somministrati solo a pazienti a rischio con sintomi lievi entro 10 giorni da personale ospedaliero specializzato;
- Sono sicuri ma le circostanze “di nicchia” nelle quali possono essere prescritti rendono difficile accertarne pienamente l’efficacia;
- La situazione emergenziale ha giustificato la distribuzione in diversi ospedali, a partire da quelli del Lazio, della Toscana, della Campania e della Liguria.
Cosa sono i monoclonali
Parliamo di anticorpi specializzati nel riconoscimento degli antigeni del nuovo Coronavirus, ovvero quelle glicoproteine Spike (S) che il virus utilizza per attaccare le cellule. Questi, specifici contro il patogeno, vengono prodotti attraverso particolari tecniche di lavorazione del DNA su alcune cellule immunitarie prelevate dal plasma di pazienti convalescenti che abbiano avuto una risposta immunitaria forte al Sars-Cov-2. Non sono affatto una novità, altri anticorpi monoclonali vengono utilizzati anche per altre patologie e malattie, come ad esempio per la lotta contro il cancro e per pazienti affetti da forti emicranie.
Chi ne avrà accesso
Secondo le disposizioni apparse nella Gazzetta Ufficiale del 9 marzo, la somministrazione dovrà essere eseguita non oltre i 10 giorni dai primi sintomi. In allegato al decreto troviamo una tabella che ci permette di considerare le linee guida per i criteri di selezione dei pazienti a seconda dell’età e della situazione clinica personale, escludendo del tutto i soggetti ricoverati per Covid19 o che ricevono ossigenoterapia.
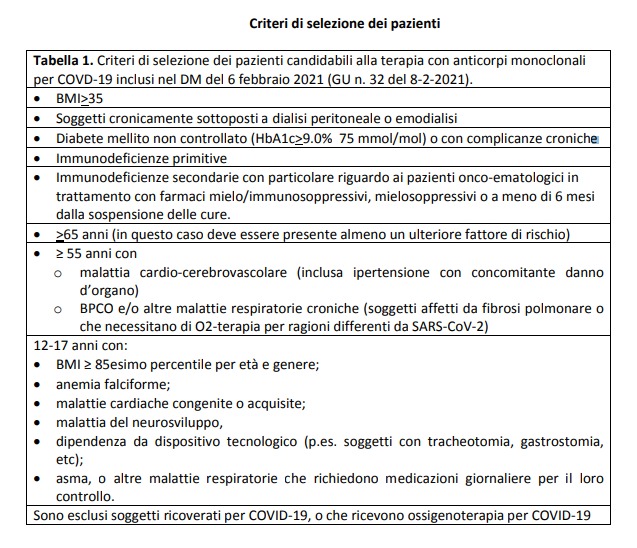
L’azienda Eli Lilly suggerisce una riduzione di mortalità pari al 70% e anche Regeneron sembra mostrare evidenze simili. Quindi al momento i candidabili alla somministrazione per infusione endovenosa in ospedale saranno i pazienti con sintomi lievi sopra i 12 anni con almeno un fattore di rischio. Sopra i 65 anni dovranno presentare almeno due fattori di rischio (il primo è l’età stessa).
Si parla di pazienti a rischio non ospedalizzati, quindi sarà necessario un operatore sanitario in grado di eseguire correttamente le infusioni endovenose. Occorre accertare la presenza di fattori di rischio e sintomi lievi o moderati, associati alla positività al SARS-CoV-2. Non è auspicabile che si acquistino i monoclonali in farmacia. Sarà necessario il responso del medico di famiglia. La diagnosi dovrà essere tempestiva. Come accennavamo la finestra temporale è di 10 giorni. Entro tale finestra il paziente dovrà recarsi in ospedale, assicurandosi di non contagiare nessuno durante il tragitto.
I dubbi e l’efficacia
Un primo punto da considerare riguarda proprio i pazienti che verranno sottoposti al trattamento, ossia quelli che presentano sintomi lievi. Non sappiamo, allo stato attuale delle cose, come potrà essere dimostrato un collegamento tra somministrazione e un mancato peggioramento dei sintomi.
Le evidenze sulla loro efficacia risultano ancora preliminari, come spiegavamo in un precedente articolo, e sono stati anche oggetto di studio per quanto riguarda la potenziale associazione tra il loro utilizzo e l’emergere di varianti, un elemento da non sottovalutare. Proprio su questo punto negli Stati Uniti l’FDA ha rivisto la sua posizione raccomandando maggiore prudenza.
Un grosso dubbio da risolvere consiste nel pericolo varianti. Ne avevamo parlato con il genetista Marco Gerdol in un articolo dedicato all’argomento, riportando le condizioni grazie alle quali potrebbero essere generate delle varianti del virus Sars-Cov-2:
Nel Regno Unito puntano sulla terza ipotesi, quella di un paziente immunodepresso molto raro in cui ci sia stata una lunga persistenza del virus con un’alta carica virale. Il genoma virale in questo genere di paziente, trattato con plasma iperimmune e Rendevisir, viene sottoposto a una «pressione evolutiva» artificiale che tende ad accumulare delle mutazioni con un ritmo molto più elevato rispetto al resto della popolazione.
Non ci sarebbe solo questo problema, bisognerebbe considerare anche l’eventuale comportamento che potrebbero avere gli anticorpi con altre varianti. Di recente in America, precisamente negli stati della California, dell’Arizona e del Nevada, sono state sospese le somministrazioni dei monoclonali della Eli Lilly’s perché ritenuti in qualche modo non soddisfacenti contro la variante “Californiana”. Anche se secondo quanto dichiarato da un portavoce della società a Endpoints News, il prodotto dovrebbe riuscire a garantire l’effetto neutralizzante contro la variante.
Il problema del costo
Un altro problema maggiore potrebbe essere quello dello scarso tempo a disposizione della ricerca, non proprio a buon mercato. Vi sono poi difficoltà che la situazione pandemica pone nell’accertamento di eventuali benefici nei pazienti ritenuti a rischio di sviluppare forme gravi di Covid-19.
Rispetto a un mese fa abbiamo qualche dato in più riguardo all’efficacia, specialmente sul cocktail di Regeneron, ma su dosaggi particolari e nessuna novità particolarmente significativa. Il grosso dei limiti lo abbiamo dal punto di vista pratico, ma le principali critiche riguardano il costo dell’operazione che sembra sproporzionato rispetto ai risultati attesi. Tra i principali critici troviamo la giornalista scientifica Roberta Villa in un post del 7 febbraio 2021:
Spero anche che il nuovo governo abbia ancora la possibilità di fermare la folle iniziativa di regalare a un’azienda, senza basi scientifiche, una cifra pari a UN QUARTO di tutto il budget per la ricerca biomedica in Italia (come se non esistessero altre malattie, dal cancro alle malattie genetiche a quelle cardiovascolari). Per una “sperimentazione” che ha bypassato ogni metodo di bando e selezione, scavalcando mille progetti senza dubbio più meritevoli, senza peer review ma per un’esplicita, e rivendicata con orgoglio, operazione di lobby.
Conclusioni
Visti gli investimenti importanti sui due farmaci, non ci resta che augurarci che i monoclonali si rivelino davvero all’altezza delle aspettative. Finora abbiamo certamente dati che ne supportano l’efficacia, senza rilevanti indizi di pericolosità per i pazienti. I limiti degli ultimi studi a riguardo e delle particolari circostanze nelle quali i monoclonali dovrebbero funzionare, ci portano inevitabilmente a raccomandare una certa prudenza.
Open.online is working with the CoronaVirusFacts/DatosCoronaVirus Alliance, a coalition of more than 100 fact-checkers who are fighting misinformation related to the COVID-19 pandemic. Learn more about the alliance here (in English).
Leggi anche:
- Anticorpi monoclonali sì, ma con cautela. Per Eli Lilly e Regeneron l’efficacia è ancora limitata
- Monoclonali italiani, la biologa del team di ricerca : «Il nostro anticorpo funziona anche in piccole dosi» – L’intervista
- Anticorpi monoclonali, tra costi e varianti saranno davvero la svolta?
- La risposta di Regeneron ed Eli Lilly alle varianti Covid? Una mappa delle mutazioni che sfuggono agli anticorpi
- Ricciardi: «Sul piano vaccini Arcuri non può far tutto». E per gli anticorpi monoclonali si perde tempo: «Funzionano, cosa aspettiamo?»
- Aifa apre alla ricerca sugli anticorpi monoclonali. Erano stati usati per curare Trump dal Covid
- Farmaci anti-Covid, in arrivo finalmente anche in Italia gli anticorpi monoclonali. Ecco perché è una buona notizia
